- E-mail : info_marketing@jindunchemical.cn
- Phone : +86 21 64057580
- Address : Shanghai China
Procédé de synthèse amélioré pour le succinate de troglitazone, un médicament contre le diabète : minimisation de la génération d'impuretés
Troglitazone succinate, une nouvelle DPP orale4 inhibiteur développé par Takeda
Pharmaceuticals, a été approuvé pour le traitement du diabète de type II en
Le Japon en mars26,2015.
Les données d'activité ont montré que la troglitazone succinate inhibe la DPP-4 Suite
efficacement que l'Alogliptin, un autre médicament contre le diabète de type II développé par Takeda
Pharmaceuticals, et Sitagliptin (nom commercial : Genovel), un poids lourd
médicament hypoglycémiant appartenant à Merck Sharp & Dohme, et, de plus, le
la sélectivité du médicament était excellente.
C'est en raison de l'effet thérapeutique unique et des bonnes perspectives de marché de la troglitazone succinate que les chercheurs pharmaceutiques ont amélioré son
processus de préparation et développement de nouveaux processus de préparation.
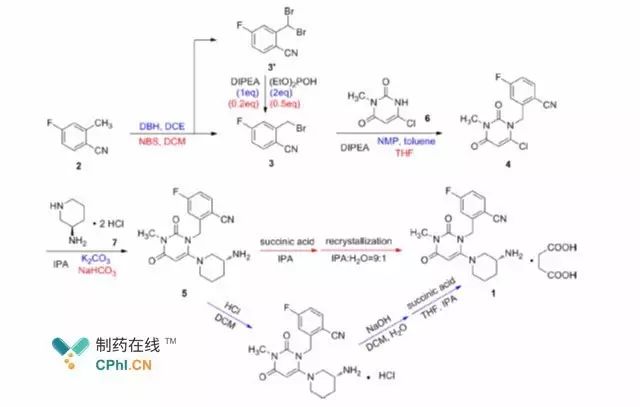
Chiffre1 Procédé de synthèse du succinate de troglitazone
Takeda Pharmaceutical'Le procédé de synthèse du succinate de troglitazone est
montré dans la figure1. Le parcours est basé sur4-fluoro-2-méthylbenzonitrile comme
matériau de départ et composé3 est obtenu après bromation ; composé3 boîte
être condensé avec intermédiaire6 obtenir un composé4, et encore condensé
avec composé7 pour obtenir la troglitazone, qui peut être préparée avec succès par
acidification et recristallisation supplémentaires du succinate de troglitazone.
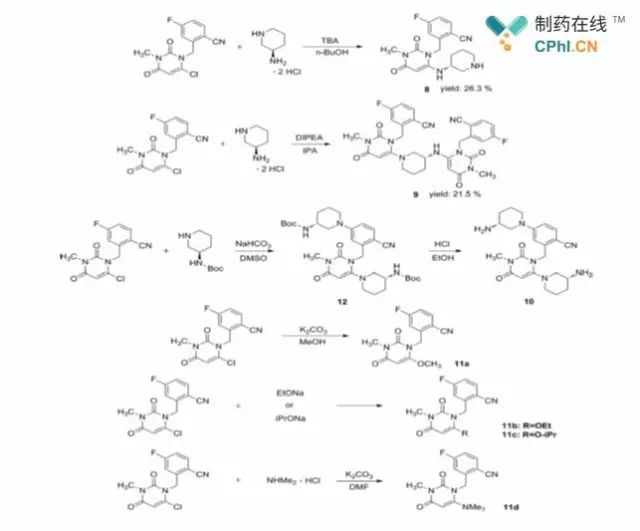
Chiffre2 Synthèse de composés8-11
Les chercheurs ont noté que l'étape de substitution nucléophile est essentielle pour obtenir
régiosélectivité élevée pour la réaction. Pour la condensation du composé4 avec
composé7, afin d'éviter la formation de l'isomère régional8 (Chiffre2),
certains chercheurs avaient signalé dans2016 une étude d'amélioration de l'optimisation de ce
étape utilisant un composé N-protégé7 condensé avec composé4, mais c'était
difficile d'éviter la formation de sous-produits tels que les produits de cyanohydrolyse
lors de la déprotection. Dans la nouvelle étude, les chercheurs ont optimisé les conditions
de plusieurs étapes, dont cette étape.
Dans les rapports précédents, la matière première initiale2a réagi avec1
équivalent de1,3-dibromo-5,5-diméthyléthanoylurée dans un solvant DCE pour donner principalement
produit3&39;, qui a ensuite été débarrassé d'une molécule de HBr sous diéthyl
phosphite, conditions DIPEA pour donner le composé3. Dans le procédé amélioré, le
les chercheurs ont réussi à remplacer une classe de solvants toxiques, le DCE, par un
solvant, DCM, et en ajustant les équivalents, etc., pour atteindre le pot unique
préparation du composé3. Par la suite, les chercheurs ont étudié la
substitution nucléophile plus systématiquement, et les impuretés formées dans ce
étape sont principalement composées8, composé9 et composé10 montré dans la figure2; lorsque
le solvant protonique (MeOH, EtOH, i-PrOH ou DMF) est utilisé pour cette réaction,
impuretés11un-11d sont formés. pour mieux étudier ces impuretés, les chercheurs
les a également synthétisés spécifiquement (Figure2).
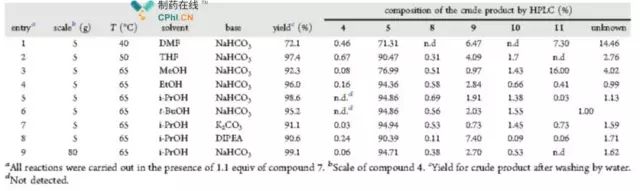
Chiffre3 Dépistage des conditions de substitution nucléophile
Comme le montre la figure3, les chercheurs ont systématiquement examiné les étape de substitution nucléophile pour des conditions telles que la température de réaction, utilisation de solvants et de bases, et analyse systématique des impuretés par HPLC moyens. Il a été constaté que lorsque le bicarbonate de sodium était utilisé comme catalyseur de base, l'isopropanol comme solvant, et la température de réaction était65°C, la réaction les impuretés pourraient être réduites au minimum avec un rendement de99.1% (entrée9).
La pureté du produit brut de troglitazone synthétisé à l'aide du processus amélioré était jusqu'à94%, ce qui était une grande amélioration par rapport à l'original traiter. Après nouvelle acidification et recristallisation, le succinate de trigliptine d'une pureté de99.93% a été obtenu avec succès.
En conclusion, le nouveau procédé a développé avec succès une méthode efficace et voie précise pour la synthèse du succinate de troglitazone, un médicament contre le diabète, réduisant de nombreuses impuretés dans le processus d'origine à des limites très basses et éviter avec succès l'utilisation de solvants toxiques tels que1,2-dichloroéthane. Cette sera sans aucun doute d'une grande utilité pour répondre au marché en expansion des succinate de troglitazone.
-
date
2022-10-10
-
location
Shanghai, China













































